SISTEM TERNER CAIR-CAIR
Ekstraksi cair-cair merupakan suatu metode penyarian atau pemisahan senyawa atau komponen dari campuran senyawa berupa larutan dengan suatu pelarut. Proses ekstraksi cair-cair dilakukan melalui dua tahapan, yaitu pencampuran/mixing bahan/senyawa yang akan diekstraksi (diluen) dengan pelarut (solven) yang sesuai dan pemisahan kedua fasa cair tersebut. Campuran diluen dan solvent bersifat heterogen atau tidak larut (immiscible), sehingga menghasilkan dua fasa yaitu fasa rafinat dan fasa ekstrak.mFase ekstrak merupakan fasa pelarut dengan solute, sedangkan fasa rafinat adalah fasa diluen. Ekstraksi cair-cair dilakukan ketika pemisahan secara destilasi tidak dapat dilakukan karena faktor tertentu, seperti pembentukan azeotrop atau kepekaannya dengan panas. Prinsip ekstraksi cair-cair didasarkan dengan adanya suhu dan tekanan yang konstan, dimana senyawa-senyawa yang akan terdistribusi dalam proporsi yang sama diantara dua fasa yang tidak saling campur. Distribusi tersebut disebut sebagai distribusi Nernst Terbentuknya dua fasa tersebut karena adanya perbedaan konsentrasi pada keadaan setimbang yang disebut sebagai koefisien distribusi (Ko) atau Koefisien partisi. Ko merupakan tetapan pada temperature dan tekanan tertentu yang dapat dihitung dengan rumus sebagai berikut:
KD = [A]2/[A]1
Dimana, [A]2 merupakan konsentrasi analit dalam fase organik atau ekstrak dan [A]1 merupakan konsentrasi analit dalam fase air (Nasyanka et al., 2020).
Sistem tiga komponen pada suhu dan tekanan tetap mempunyai jumlah derajat kebebasan yang paling banyak dua, maka diagram fasa sistem ini dapat digambarkan dalam satu bidang datar yang berupa suatu segitiga sama sisi yang disebut diagram terner. Jumlah fasa dalam sistem zat cair tiga kompoen tergantung pada daya saling larut antar zat cair tersebut dan suhu percobaan. Andaikan ada tiga zat cair A, B dan C. A dan B saling larut sebagian. Penambahan zat C ke dalam campuran A dan B akan memperbesar atau memperkecil daya saling larut A dan B. Untuk satu fasa kita membutuhkan dua derajat kebebasan untuk menggambarkan sistem secara sempurna dan untuk dua fasa dalam kesetimbangan, satu derajat kebebasan. Cara terbaik untuk menggambarkan sistem tiga koponen adalah dengan mendapatkan suatu kertas grafik segitiga. Konsentrasi dapat dinyatakan dalam istilah % berat atau fraksi mol. Diagram fasa merupakan cara mudah untuk menampilkan wujud zat sebagai fungsi suhu dan tekanan. Contoh khas diagram fasa tiga komponen adalah air, kloroform, dan asam asetat. Dalam diagram fasa bahwa zat tersebut diisolasi dengan baik dan tidak ada zat lain yang masuk maupun keluar dari sistem ini. Asam asetat lebih suka pada air dibandingkan kloroform oleh karenanya bertambahnya kelarutan kloroform dalam air lebih cepat dibandingkan kelarutan air dalam kloroform. Penambahan asam asetat berlebih akan membawa sistem bergerak ke daerah atau satu fasa (fasa tunggal). Namun demikian saat komposisi mencapai titik a3, ternyata masih ada dua lapisan maupun sedikit. Setelah penambahan asam asetat diteruskan, pada saat akan menjadi satu fasa yaitu pada titik P. Titik P disebut pleit point atau titik jalin yaitu semacam titik kritis (Rahmawati, 2014).
Salah satu cara untuk memperlihatkan variasi kesetimbangan fase dengan sistem komposisi digunakan diagram fase segitiga, diagram ini berupa satu segitiga sama sisi yang disebut “Diagram Terner”, dengan tiap sudut segitiga tersebu tmenggambarkan suatu komponen murni, jika dalam system hanya terdapat satu fase maka V=2, berarti untuk menyatakan suatu system dengan tepat perlu ditentukan konsentrasi dari dua komponennya, sedangkan bila dalam sistem terdapat dua fase kesetimbangan maka V=1, berarti hanya satu komponen yang harus ditentukan konsentrasinya dan konsentrasi komponen lain sudah tertentu berdasarkan diagram fase untuk system tersebut. Oleh karena itu system tiga komponen pada suhu dan tekanan tetap punya derajat kebebasan maksimum = 2 (jumlah minimum=1), maka diagram system ini dapat digambarkan dalam suatu bidang datar berupa suatu segitiga tersebut menggambarkan suatu komponen murni (Sukardjo, 1997).
Kesetimbangan selain dipengaruhi oleh suhu dan tekanan juga dipengaruhi komposisi sistem. Dalam hal ini, air dan asamasetat glaisal memiliki daya saling larut yang tinggi.Hal ini disebabkan karena sifat kepolaran antara masing-masing komponen zat tersebut. Yaituair bersifat polardanasam asetat glasial bersifat semi polar. Sesuai prinsip like disolve likekomponen dengan sifat kepolaran serupa akan melarutkan sesamanya.Penambahan kloroform yang memiliki sifat kepolaran non-polar, mengakibatkan perubahan komposisi sistem tersebut (Dwitama, 2016).
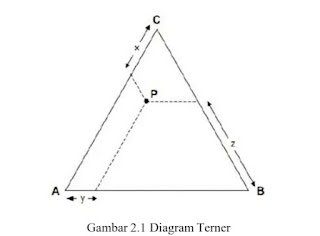
Untuk campuran yang terdiri atas tiga komponen, komposisi (perbandingan masing-masing komponen) dapat digambarkan di dalam suatu diagram segitiga sama sisi yang disebut dengan Diagram Terner. Komposisi dapat dinyatakan dalam fraksi massa (untuk cairan) atau fraksi mol (untuk gas). Diagram tiga sudut atau diagram segitiga berbentuk segitiga sama sisi dimana setiap sudutnya ditempati komponen zat. Sisi-sisinya itu terbagi dalam ukuran yang menyatakan bagian 100% zat yang berada pada setiap sudutnya Jumlah fasa dalam sistem zat cair tiga kompoen tergantung pada daya saling larut antar zat cair tersebut dan suhu percobaan. Andaikan ada tiga zat cair A, B dan C. A dan B saling larut sebagian. Penambahan zat C kedalam campuran A dan B akan memperbesar atau memperkecil daya saling larut A dan B. Pada percobaan ini hanya akan ditinjau sistem yang memperbesar daya saling larut A dan B. Dalam hal ini A dan C serta B dan C saling larut sempurna. Kelarutan cairan C dalam berbagai komposisi campuran A dan B pada suhu tetap dapat digambarkan pada suatu diagram terner. Prinsip menggambarkan komposisi dalam diagram terner dapat dilihat pada gambar :
sumber : Atkins, 2006.
Titik A, B dan C menyatakan kompoenen murni. Titik-titik pada sisi AB, BC, dan AC menyatakan fraksi dari dua komponen, sedangkan titik didalam segitiga menyatakan fraksi dari tiga komponen. Titik P menyatakan suatu campuran dengan fraksi dari A, B, dan C masing-masing sebanyak x, y, dan z (Atkins, 2006).
DAFTAR PUSTAKA
Atkins, P.W. 2006. Kimia Fisika. Jakarta: Erlangga.
Dwitama, M.I. 2016. "Diagram Terner Sistem Zat Cair Tiga Komponen Campuran Air-Klorofom-Asam Asetat Glasial dan Air-CCl4-Etanol". Jurnal Kimia FIsika. Vol. 4(2): 3-11.
Nasyanka, A.L. 2020. Pengantar Fitokimia. Jawa Timur: Qiara Media.
Rahmawati, H. 2014. "Kesetimbangan Fasa". Praktikum Kimia Fisik II. Vol. 2(1): 1-11.
Sukardjo. 2005. Kimia Fisika. Jakarta: Erlangga.